钜大锂电 | 点击量:0次 | 2018年04月29日
锂离子电池的工作原理
从金属锂到锂离子的变迁
锂电池的研究始于1912年的G.N.刘易斯,但是,直到70年代初,锂一次电池才首次得以商业化。到了20世纪80年代,科学家们开始尝试开发锂二次电池,但用作负极材料的金属锂具有很大的不稳定性,原材料的限制从而导致进展缓慢。
锂无疑是所有金属中最轻的,因此单位重量下具有最高的电化学电位和最大的比能量,以金属锂为阳极(负极)[1]的二次电池能量密度是非常高的。然而,上世纪80年代中期,人们发现在电池循环过程中金属锂负极会产生有害的枝晶,枝晶生长过程中容易刺穿隔膜导致电池短路。接着,电池温度迅速上升并接近锂的熔点,最终热失控导致电池着火甚至引起爆炸。例如在1991年,由于手机锂电池在使用过程中释放的可燃气体造成人脸灼伤,使得大量销售到日本的金属锂二次电池被全部召回。
金属锂具有固有的不稳定性,在充电过程中表现尤为明显,因此科研人员把重点转移到对非金属溶液中锂离子的研究。虽然相对于金属锂而言,锂离子电池比能量较低,但只要电池制造商和电池组封装按照安全条例实施,同时保持电压和电流的安全水平,那么锂离子电池的安全性是可以保障的。从1991年索尼公司商业化生产第一批锂离子电池至今,锂离子电池已然成为最有前途和发展最快的市场。不过与此同时,研究人员依旧没有放弃对安全的金属锂电池的开发。
正极材料锂钴氧化物的发现应归功于JohnGoodenough(1992)。据说,当时JohnGoodenough与一位受雇于日本NTT公司的毕业生一起工作。JohnGoodenough发明了锂离子电池后不久,那学生便将这一发明带回了日本。1991年,索尼便宣布获得了一个锂钴氧化物正极材料的国际专利,随后多年,诉讼接踵而至,但是索尼仍能够持有专利而JohnGoodenough却一无所获。
锂离子电池体系的闪光点
锂离子电池的比能量是镍镉电池的两倍,此外相比于镍系统的1.20V,有较高的理论电压(3.60V),前者更有益于理论比能量的增加。同时,电极活性材料的改进在提升能量密度方面具有更大的潜力。锂离子电池的负载性能很好,理想的单电池在3.7至2.8V的电压范围内具有平坦的放电曲线,呈现出良好的能量储备性能,而镍基单电池只具有1.25到1.0V的较窄范围的平坦放电区间。
1994年,18650型号[2]的圆柱形锂离子电池容量仅1100mAh成本却超过了10美元,而到2001年,成本则降为2美元,容量升至1900mAh。今天,高能量密度的18650柱形电池可提供超过3000mAh的容量而且成本更加低廉。成本的降低,比能量的增加以及不含有毒物质使得锂离子电池在便携式设备上的应用得到普遍认同,也逐渐从最初的消费品市场一步步走向了电动汽车动力系统在内的重工业领域。
2009年,电池收益中大约38%都是锂离子电池贡献的。锂离子电池易于维护的特点也是许多其他化学电池无法匹敌的。锂离子电池无记忆效应,不需要完全充放电来保持性能,而且自放电率不足镍基电池的一半,这使得锂电池在燃油量表上得到良好应用。此外,锂离子电池具有3.60V的额定电压,通过电池组设计可以直接用作手机和数码相机的蓄电池,简化工艺并降低了成本。但是不足之处在于需要保护电路防止漏电,还需避免高昂的价格。
从材料角度看锂离子电池的分类
与铅基、镍基电池类似,锂离子使用正极(阴极),负极(阳极)和电解质作为导体。正极是金属氧化物,负极由多孔石墨构成。在放电过程中,锂离子通过电解质和隔膜从负极移动到正极;充电时,锂离子沿着相反的方向从正极流向负极,如图1所示。
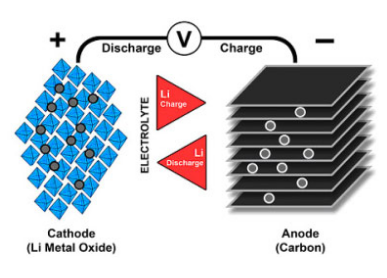
图1Li+在锂离子电池的脱嵌/嵌入
当电池充放电时,Li+在正极和负极之间穿梭。放电时,阳极发生氧化,失去电子,同时阴极还原,得到电子;充电时,电荷运动方向相反。
按电极材料来分,锂离子电池有许多种类型。但选择不同的材料,其电池性能也会有很大差异。
正极材料均含有Li+。常见的有锂钴氧化物(钴酸锂),锂锰氧化物(也称为尖晶石或锰酸锂),磷酸铁锂、镍钴锰三元材料(NMC)[3]和锂镍钴铝氧化物(NCA)。所有这些材料都有理论比能量上限(锂离子有一个理论容量约2000kWh,是商用锂离子电池比能量的10倍以上)。
索尼公司最初生产的锂离子电池采用焦炭(一种煤炭产品)作为负极材料。自1997年以来,包括索尼在内的大多数锂离子电池制造商,将负极材料转变为石墨,从而获得了平坦的放电曲线。石墨是碳的一种形式,多被用于铅笔中。在充电过程中,它能很好地储存锂离子,并且循环周期长,稳定性好。在碳材料中,石墨用得最普遍,其次是硬碳和软碳。而其他碳,例如碳纳米管,仍未发现其商业用途。图2对比了以石墨为负极的现代锂离子电池和早期焦炭负极的锂离子电池的电压放电曲线。
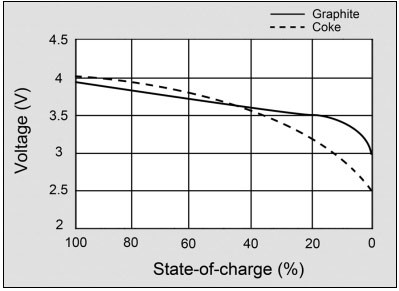
图2锂离子电池的放电曲线
在正常使用的放电范围内,电池应该有一个平坦的电压曲线,这一方面石墨材料比早期的焦炭做得更好。
负极材料也在发展,科研人员不断尝试一些新的材料,其中包括硅基的合金。在这种合金中,六个碳原子键接一个锂离子,一个硅原子可以键接四个锂离子。这意味着硅负极理论上可以储存石墨材料的10倍能量。目前,硅材料在降低荷载电势和循环寿命的代价下,比容量上已经提高了20%-30%。但令人头疼的问题是,在充电过程中,锂离子嵌入硅基材料之后其体积容易发生膨胀(可膨胀到初始体积的四倍多)。
纳米结构的钛酸锂盐作为负极材料有着很好的循环寿命和负荷容量,极好的低温性能,较好的安全性能,但是其比容量低,成本高昂。
不同制造商在电池各种性能之间的权衡
对正负极材料所做的各种研究可以让制造商综合考虑,来提高电池的内在性能,但是一项指标的加强往往是以另一项性能的牺牲为代价的。在所谓的“储能电池”中,电池制造商更倾向于提高比容量以达到长期使用的目的,但是这样做可能会导致其比功率和循环寿命降低。而在“动力电池”中,可能会为了达到高功率而牺牲一定的容量。“混合电池”的上述各项性能相对较为均衡。“长寿电池”则是为了长期使用而研制的。这些特殊的电池一般体积较大,成本更高。
制造商如果用镍替代钴就会轻而易举地获得高比容量和低成本的锂离子电池,但是这会降低电池稳定性。尽管一些刚成立的公司可能会更多地关注电池比容量,以便于更快地获得市场的认可,但是安全性和稳定性是不容忽视的,声誉好的企业都会把安全和长效放在极其重要的位置。
改善现有材料任重而道远
锂离子电池行业主要应用于可携带电子产品方面,其电动动力系统的长期稳定性仍然是未知数。循环寿命、持久性能和运营成本,这三者只有在电动汽车经过几次更新换代并且通过客户确认接受后才能得知。下图3总结了锂离子电池的优点和局限性。

图3:锂离子电池的优点和局限性
综合来看,提高电池性能、寻找更好的化合物,这两大挑战在当今尤为激烈。任何一项瓶颈的克服都会让电池比近乎免费的化石燃料更具有决定性优势。尽管媒体毫不吝啬地对电池重大突破广泛报道,但现在仍未到写文章称赞胜利的时刻。即使某项进展被确认批准,仍旧需要数年时间才能走入市场,真正“飞入”寻常百姓家。
注解:
[1]当消耗能量,如在二极管、真空管或者充电电池中时,阳极材料为正极材料;反之,当放电时,例如电池的放电过程,阳极材料为负极材料。
[2]圆柱形锂离子电池在上世纪九十年代中期得到发展,经测得直径是18mm,长度是65mm,多用于笔记本电脑。
[3]一些镍锰钴酸锂电池体系被写作NCM,CMN,CNM,MNC和MCN。这些体系基本上是一样的。
















